市场竞争格局
HPV DNA检测试剂大致分为两类,一类是罗氏为代表的2+12,俗称不分型或16/18分型,一类是凯普或者亚能的21或者23分型,俗称全分型。
当然还有像凯杰依靠cutoff值给与风险评估的,还有检测RNA的,如豪洛捷、河南科蒂亚等。
无论怎么分类或者命名都会不MECE,也不用太纠结,看个大概,看个趋势,本文主要参考国家临检中心EQA数据,“人乳头瘤病毒-16,-18及分型”,“人乳头瘤病毒基因分型”。
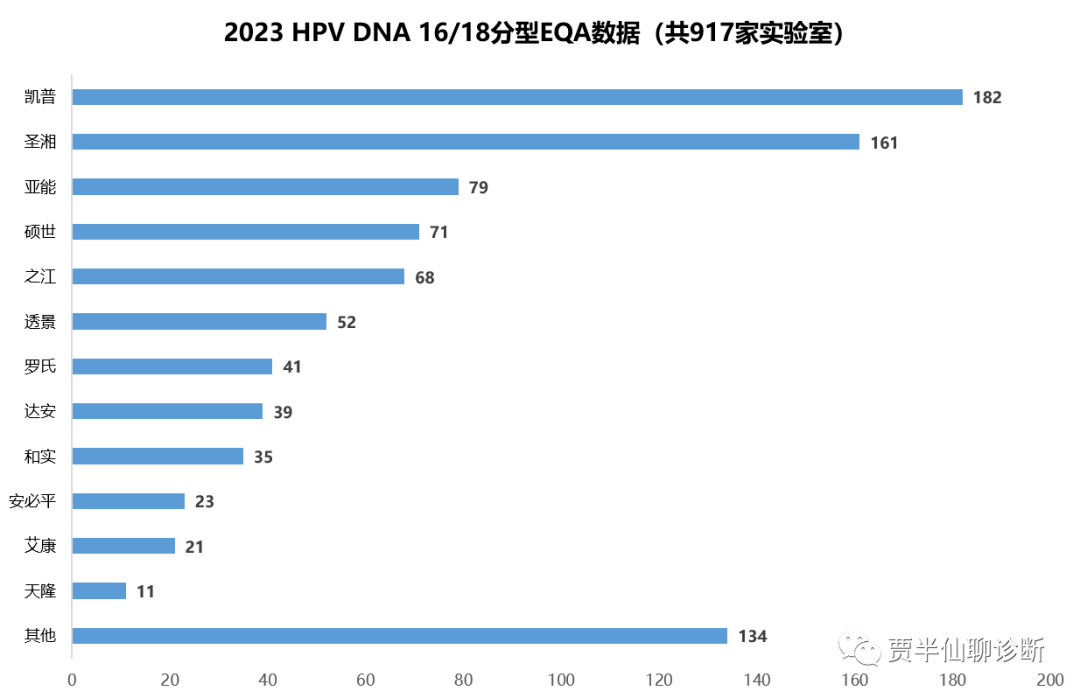
先看前者,不分型产品,主要应用在两癌筛查领域。从2023第二次EQA数据可以看出凯普、圣湘领先优势比较大,排名3-5的分别是亚能、硕世和之江。
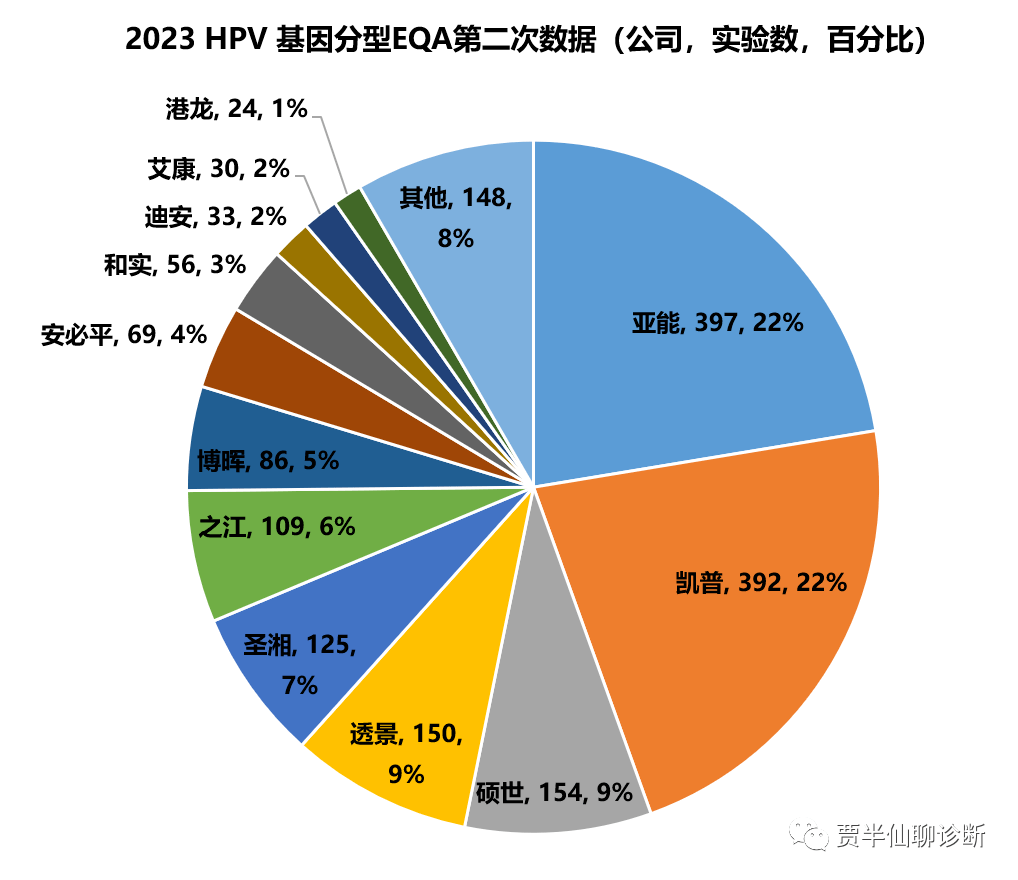
目前市面上主流的还是全分型产品,主要用在医疗机构的辅助诊断。凯普和亚能依然遥遥领先,排名3-5名的分别是硕世,透景和圣湘。与2021年数据相比,硕世和圣湘均有大幅增长。
必须说明的是EQA数据仅仅是一个方面,仅检测DNA,如豪洛捷公司就没参与;再有价格因素没考虑,每家实验室使用数量也未考量;但依然可以管中窥豹的。
再有需要说明的是每个厂家会有多个HPV检测产品,甚至是不同检测平台,以适应不同的应用场景,具体可参考之前的内容:一文读懂HPV检测技术与市场竞争格局
市场容量与增长率
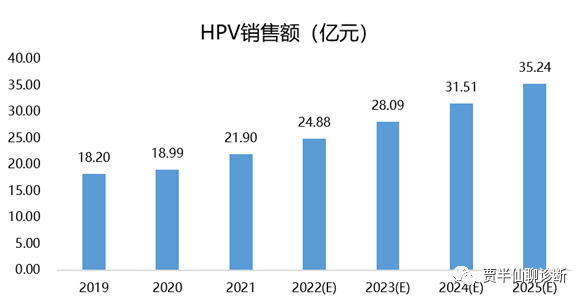
根据2022 IPSOS Market tracker数据HPV销售数据以出厂价计约为30亿元。
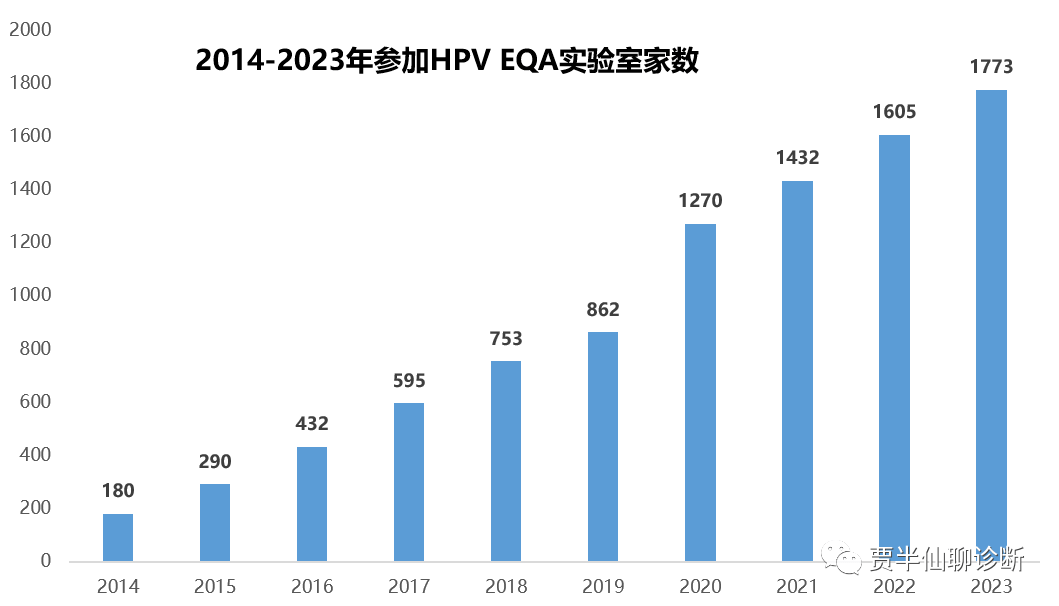
从EQA数据可以看出从2014-2023年参加实验室的数量从180家大幅增加到1773家,10年复合增长率达到惊人的25%。
还是以头部公司凯普生物为例,看看这个市场增速有多高:2019年6月累计检测量是2700万人份,到2022年累计检测量是5000万人份,也就意味着3.5年共检测了2300万人份。
而凯普生物的2023H1公司HPV检测产品累计使用量近500万人次,比去年同期增长27.99%,比2019年同期增长60.28%,呈现出较快的增长。
再看个后来者,华大基因在2017年获证,截止2023年6月份已经累计检测HPV>700万人份,2023年就有可能做到150万人份。
并且后续还会有更大的市场增量:根据筛查指南30-65岁的女性需进行HPV检测数量约为3.6亿人,平均每年的检测比例在30%,同时今年1月20日,国家卫健委发文《关于印发加速消除宫颈癌行动计划(2023-2030)的通知》提出:
到2025年,适龄妇女宫颈癌筛查率达到50%;
到2030年,适龄妇女宫颈癌筛查率达到70%。
按照目前宫颈癌筛查策略,保守估计以第一阶梯宫颈细胞学检查和HPV检查为主的筛查市场将扩大1倍以上!
除了政策外,其他驱动因素还有:
两癌筛查 VS 辅助诊断
通俗意义上说两癌筛查检测量比较大,让我们来看组数据:截至2018年开展免费宫颈癌筛查近1亿人次;截至2020年开展免费宫颈癌筛查1.3亿人次,目前(国家卫生健康委妇幼司司长宋莉在2023年5月31日发布会上介绍)已累计开展了宫颈癌免费筛查1.8亿人次。
稍微做个减法得到:2019-2020年共开展宫颈癌筛查3千万人次;2021-2022共开展宫颈癌筛查5千万人次,也可以看出筛查人群数量近两年已有明显扩大。
但两癌筛查大部分人群还是以TCT为主,如2019年HPV DNA检测在两癌筛查中不足500万人份,而同年在临床端HPV检测量在1300-1400万人份。如第二部分讨论得知两癌筛查市场HPV DNA检测具有更大的想象空间。
就如同第二部分讨论,未来几年两癌筛查人群渗透率将有大幅提升,在美国将HPV检测作为初筛标准几年时间后,《HPV DNA检测应用于健康体检人群子宫颈癌初筛的专家共识(2022)》、《人乳头瘤病毒核酸检测用于宫颈癌筛查中国专家共识(2022)》、《中国子宫颈癌筛查指南(2023)》均推荐高危型HPV核酸作为初筛方法。
筛查证获批会改变格局吗
2015年国家药监局发布《人乳头瘤病毒(HPV)核酸检测及基因分型试剂技术审查指导原则》后,多个厂家开始了申报工作。
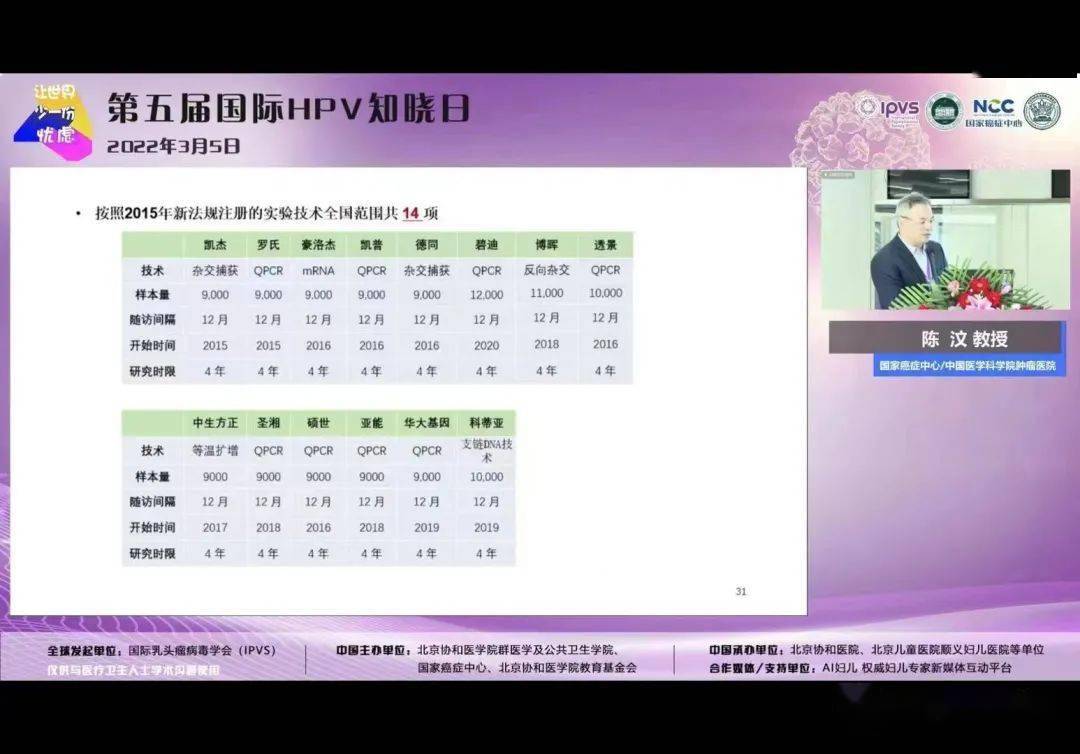
在今年6月凯普生物率先获得宫颈癌HPV筛查第一证。

凯普按照指导原则设计临床试验方案,于2016年启动大规模前瞻性临床研究,招募上万名女性完成三年跟踪随访研究,率先取得国家药监局注册批件,其明确适用于“宫颈癌初筛”、“宫颈癌联合筛查”、“ASC-US人群分流”,引起HPV市场的广泛关注。
9月份,德同生物14种高危型人乳头状瘤病毒(HPV)核酸检测试剂盒(DH2 )和人乳头状瘤病毒(HPV)核酸检测试剂盒(DH3),作为两款采用杂交捕获-化学发光法的产品,是国家药监局批准的宫颈癌筛查预期用途产品,明确适用于“宫颈癌初筛”、“宫颈癌联合筛查”、“ASC-US人群分流”。
同时,两张初筛证的颁布意味着德同生物拥有全球首张杂交捕获HPV初筛证(DH2)和全球首张杂交捕获HPV分型初筛证(DH3)(2+12)。
其他厂家获证还会远吗?
问题来了,筛查证的获批是否会对HPV筛查市场带来新的变数?
我的观察是短期不会,临床是辅助诊断不会影响,两癌筛查市场招标因素,一般一个项目周期是3年,一时半会儿就替换也不太现实;
长期看肯定是利好这些获得初筛证的厂商,有了筛查肯定要用有筛查预期用途的产品,向头部聚集效应会越来越明显。
集采的风险与应对
我曾经以为集采不会被纳入集采,体量小,方法多等因素,还有就是两癌筛查项目已经是事实上的集采产品,比方浙江很多地方限价都低于20元(包含试剂、耗材、服务),很多厂家表示“我不玩了”。
奈何打脸太快,目前HPV检测也是唯一一个被集采的分子项目(HBV DNA暂缓纳入)。
从其官网披露的信息看,参与HPV集采的厂家多达36家,产品/规格达到129个,其中“高危型人乳头瘤病毒(16、18型及其他细分病毒亚型)核酸检测试剂盒”的申报量最多,占比超过70%;其次是“高危型人乳头瘤病毒(16、18型及其他不细分亚型)”,最少的是“人乳头瘤病毒 (16、18型) 核酸检测试剂盒”,竞争不可谓不惨烈。
集采就意味着价格的下探,囚徒困境啊。锁炎总给出了他的预测:预估HPV高危分型的集采价格可能会在70-80元之间,HPV16、18分型的产品价格会在15-20元之间,相较于现在价格体系,降价幅度会在40-50%,具体等官网结果。
怎么应对?拥抱集采,在合理范围内争取高一分钱是一分钱,量多一人份是一人份。对头部企业是天大的利好,对新进入的玩家亦是利好,有了上车的机会。
2C端的未来
每个公司,每个营销人都有to C的梦,针对HPV宫颈癌检测产品的属性,更是大家角力的重点。
从电商平台随便一搜,都是HPV自测产品,这对于很多不方便的人群或者有隐私需求的人群,提供了极大的便利。
卖的比较好的大多是尿液样本的染色试剂盒,直接就能看到结果。
当然,也少不了HPV核酸检测的,可以分型,比如华大基因,ICL们。客户采购取样耗材,采样后回寄公司,一定时间后手机查收检测结果。
但是自采样还是对某些人群感觉不太友好。再有就是还没有被批准的自采样HPV检测试剂盒,大面积推广还有合规的风险。
有需求,就会有人来满足,比方说诺辉。今年9月的“西湖对弈”上诺辉健康也正式公布旗下宫颈癌HPV居家自取样筛查产品宫证清注册临床试验基线数据,并预计于2027年取得宫颈癌筛查注册证书。宫证清是全球首款基于尿液样本的HPV宫颈癌筛查产品。
宫证清采用诺辉健康自主研发的高危HPV分型检测技术,有望实现尿液样本自取样的宫颈癌HPV筛查,提供无痛无创居家检测的新体验,全面覆盖14种高危HPV病毒。
C端、居家自测实在是一个大命题,可以参考老刘的文章:IVD的C端会不会是一门好生意?,我分析了下,IVD的C端销售,应该这么玩。我后面有精力再专门写一篇。
HPV检测新趋势
前面有讨论到HPV检测的C端,筛查证,这两年还有一个大的趋势是甲基化产品获批。
2022年8月上海捷诺生物科技有限公司研制的“人ASTN1、DLX1、ITGA4、RXFP3、SOX17、ZNF671基因甲基化检测试剂盒(荧光PCR法)(商品名:宫安丽)获批,是国内宫颈癌HPV初筛甲基化分流第一证。从灵敏度和特异性而言,甲基化标志物在检测CIN2+以上的癌前病变的灵敏度和特异度都在0.85水平或以上,而TCT的灵敏度和特异性分别在0.65和0.75水平,传统的 HPV灵敏度虽高(0.85水平),但特异性不足(0.45水平)。
宫安丽使用甲基化特异性的PCR方法,通过检测人宫颈脱落细胞中6个基因的甲基化状态,帮助识别HPV DNA检测初筛阳性人群是否需要行进一步的阴道镜检查。
2023年3月,NMPA正式批准北京起源聚禾生物科技有限公司自主研发的人PAX1和JAM3基因甲基化检测试剂盒(PCR-荧光探针法)(商品名:禾宫康CISCER®)上市,是宫颈癌领域的第二个甲基化产品。
此外,禾宫康CISCER®与其他方法学相比,在CIN2/3+阳性检出率具有一定优势。
2023年7月湖南宏雅基因技术有限公司派仕安®PAX1基因甲基化检测试剂盒(PCR-荧光探针法)获NMPA正式批准上市,是宫颈癌领域的第三个甲基化产品。
抑癌基因PAX1甲基化检测提供了数字化的检测值(∆Cp),∆Cp值与宫颈细胞是否癌变及癌变程度之间的关系可参考下图:
依据PAX1基因甲基化检测的∆Cp值,可以更精准的判断宫颈组织是否癌变及癌变的程度,给临床医生提供更方便更准确的参考依据来辅助临床诊断和采取对应的干预治疗措施。
不过依据预期用途来看,二次分流,甲基化检测受众人群可能没有那么多,不同的文章不同的研究粗筛阳性率也不太相同,取个平均值15%,也有小几百万人次的检测市场,也算撬开了一个新的应用场景,一个增量市场。
其他的还有检测平台的优化、检测技术的迭代,miRNA等等,有机会设个专题再详细讨论。
重赏之下必有勇夫,HPV检测这么大的可见的未来更大的市场,虽然有了百十来个产品,还有很多公司在立项,在进入这个市场,你能找到差异化,独特的应用人群吗? 欢迎找半仙聊聊。
声明:以上内容来源贾半仙聊诊断,侵删。麦瑞科林专注于为HPV/DNA检测提供采样耗材。