前段时间有客户询问唾液采集后在不加DNA保存液的情况下,唾液中的DNA可以在室温放多久而不降解。
为了解答客户的疑问,于是小新测试了唾液在室温放置不同时间段提取DNA的效果情况,以及唾液与唾液保存液混合后在不同时间段提取DNA的效果。
01 实验目的
测试唾液样本在室温放置不同时间对唾液DNA的影响及唾液保存液对唾液中DNA的保存效果。
02 实验材料
1.新鲜采集的人唾液、1. 5 ml离心管若干、2 ml离心管若干
2.唾液DNA纯化试剂盒(Simgen Cat.No.3501050)、唾液DNA保存液(Simgen Cat.No.3522050)
3.台式离心机(eppendorf centrifuge 5415D)、旋涡振荡器(越新仪器,XH-C)、超微量分光光度计(Simgen Cat.No.sim-100)、电泳仪(北京六一仪器厂,DYY-6C型)
03 实验方法
整个实验温度波动范围在22~28℃。
1.用洁净的一次性水杯收集唾液:
1a. 转移400 µl唾液到一个洁净的1.5 ml离心管中(分别在室温放置0小时、0.5小时、1小时、1.5小时、4小时、7小时以及24小时),加入400 µl Buffer L5,剧烈摇晃离心管3-5次,再旋涡振荡30秒混匀。最高速(≥12000 rpm)离心1分钟。
1b. 转移400 µl唾液到一个洁净的2 ml离心管中,再加入400 µl唾液DNA保存液混合均匀(分别在室温放置4小时、7小时以及24小时),加入800 µl Buffer L5,剧烈摇晃离心管3-5次,再旋涡振荡30秒混匀。最高速(≥12000 rpm)离心1分钟。
2.将步骤1中的离心上清液倒入核酸纯化柱中(核酸纯化柱置于2 ml离心管中)(步骤1b中的上清液分两次滤过核酸纯化柱),盖上管盖,12000 rpm离心30秒。
3.弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,在核酸纯化柱中加入700 µl Buffer WA,盖上管盖,12000 rpm离心30秒。
4.弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,在核酸纯化柱中加入800 µl Buffer WB,盖上管盖,12000 rpm离心30秒。
5.弃2 ml离心管中的滤液,将核酸纯化柱置回到2 ml离心管中,13200 rpm离心2分钟。
6.弃2 ml离心管,将核酸纯化柱置于一个洁净的1.5 ml离心管中,在纯化柱的膜中央加入80 µl Buffer TE,盖上管盖,室温静置2分钟,12000 rpm离心30秒得到唾液DNA。
04 实验结果
1.在超微量分光光度计上用Buffer TE调零,测量洗脱下来的DNA,结果如下:
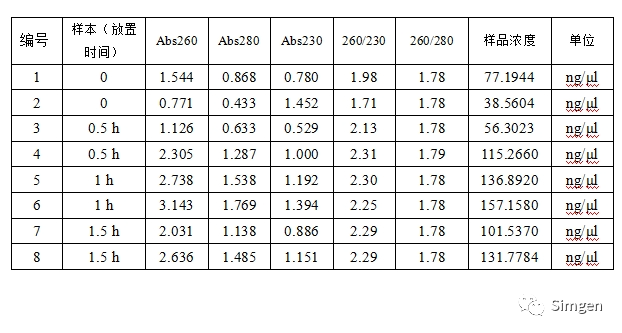
表一
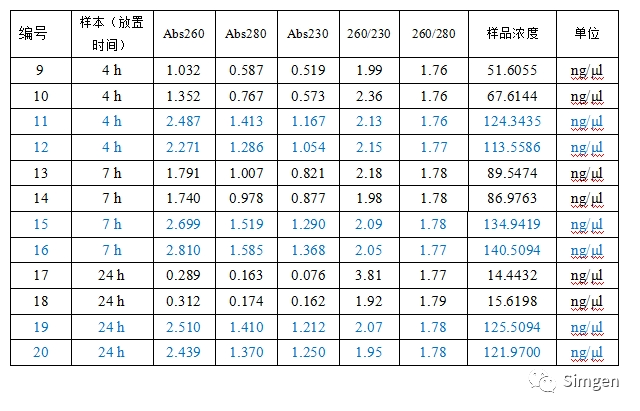
表二
* 标识成蓝色字体的是唾液样本与唾液DNA保存液混合后在室温放置不同的时间提取DNA获得的数据。
2.在1%的琼脂糖凝胶上加入5 μl洗脱的唾液DNA进行电泳,结果如下:
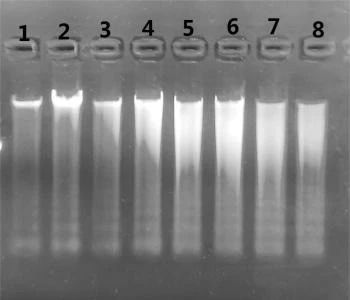
1、2:新鲜采集的唾液立刻提取的DNA
3、4:采集的唾液室温放置0.5小时提取的DNA
5、6:采集的唾液室温放置1小时提取的DNA
7、8:采集的唾液室温放置1.5小时提取的DNA
表三
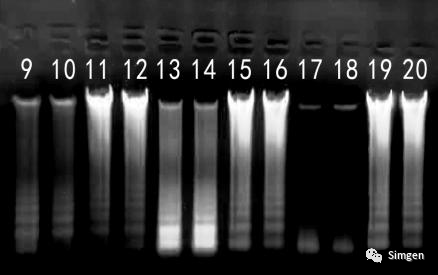
9、10:采集的唾液室温放置4小时提取的DNA
11、12:采集的唾液混合保存液室温放置4小时提取的DNA
13、14:采集的唾液室温放置7小时提取的DNA
15、16:采集的唾液混合保存液室温放置7小时提取的DNA
17、18:采集的唾液室温放置24小时提取的DNA
19、20:采集的唾液混合保存液室温放置24小时提取的DNA
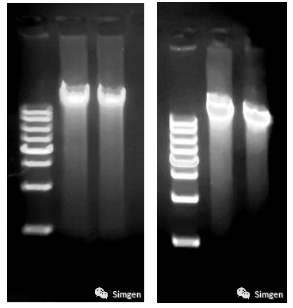
Marker:1 kb DNA Ladder
左图:唾液采集后与唾液DNA保存液混合后当天提取的唾液DNA
右图:唾液采集后与唾液DNA保存液混合后室温放置一年后提取的唾液DNA
05 讨论
1.综合表一和表二的数据我们发现,如果直接取唾液样本提取DNA,随着唾液在室温放置时间的延长,DNA的提取浓度出现了先增高(0~1小时)后降低(1~24小时)的现象。
结合图一和图二的电泳图我们可以发现,唾液中提取到的DNA均有明显的凋亡细胞DNA的特征,即DNA拖尾的带型与DNA Ladder相似。
这就说明了唾液中DNA的主要来源是脱落的口腔上皮细胞,这些细胞大多数已经死亡,细胞核中的染色体结构正处于分崩离析的过程中。
2.结合不同时间段提取的DNA电泳带型分析,我们发现唾液样本直接提取的DNA中大片段DNA(主带)随着时间的延长越来越暗,小片段DNA则亮度先增加(见泳道13,14,室温存放7小时达到最亮)后减少。
这说明有一些尚未明确的原因,比如口腔上皮细胞的自溶过程,或者是唾液中细菌滋生的一些因素导致唾液收集后其中的大片段DNA一直在持续地断裂分解成小片段DNA,这些小片段DNA在24小时后大部分都已经吸附不到DNA纯化柱上了(见泳道17,18)。
这个分解过程在1小时内对提高DNA的提取效率可能是有正向作用的(参考文章“提取DNA应该粗暴还是温柔?”),但是超过1.5小时后就能明显地发现DNA提取量在迅速地减少。
3.从表二的数据我们发现唾液与唾液保存液混合后4小时、7小时、24小时后提取到的DNA浓度变化不大,与不加保存液的唾液DNA的提取结果形成了鲜明对比,验证了唾液DNA保存液对唾液DNA的保存效果。
4.最后我们可以明确地回答用户的提问了:唾液样本收集后,DNA马上就开始降解了(或者更精确的描述应该是上皮细胞死亡后DNA就开始分解了),所以如果没有唾液DNA保存液,收集的唾液样本必须在1小时内放入﹣20℃冰箱或更低温度冷冻储藏。
室温存放的唾液DNA降解速度大致情况是4小时后分解掉50%数量的DNA,24小时后分解掉90%数量的DNA。
5.如果收集的唾液和唾液DNA保存液混合后再存放在室温,提取到的DNA则非常稳定,电泳显示的带型(见图二)也没有明显的变化。
实际上,我们曾实测过唾液与唾液DNA保存液混合后室温放置一年后提取唾液DNA的效果,从电泳上看,一年后提取的DNA带型与当天提取的DNA带型差别也不是很明显(见图三),即唾液样本经唾液DNA保存液处理后能在常温放置12个月以上而DNA没有明显的降解。
文章来源新景生物实验室,侵删。