「自采样」用于人乳头瘤病毒(HPV)的筛查,作为临床医生传统采样方式的替代方法,其有效性得到了越来越多的证据支持。自采样有效地覆盖到了筛查不足的女性,并且成为面向所有目标年龄的强大策略,显著降低了对筛查资源配置的依赖。本文旨在总结目前世界范围内 HPV 自采样的使用情况。该工作属于一项更大的项目:调查宫颈癌筛查行动,对全球覆盖率进行标准化评估。当前工作系统总结了文献和官方文件,并参考了 WHO 国家的咨询指南。
结果表明,HPV 自采样在全球的使用仍然有限。只有 17 个 (12%) 有明确筛查计划的国家推荐使用它,其中 9 个作为主要收集方法,8 个用于覆盖筛查不足的人群。我们找到了 10 个试点项目,正在评估在成熟的筛查计划中向自采样方式的转变。未来几年,全球对自采样的使用可能会增加。COVID-19 的大流行促使人们努力在全球范围内加速引入 HPV 自采样,这被认为是扩大宫颈癌筛查覆盖率的关键因素。早期实施经验有利于对新项目和现有项目的决策。
介绍
宫颈癌很大程度上是可以预防的,但仍然是目前全球女性中第四大常见癌症和第四大癌症死亡原因 [1]。这些病例中的大多数发生在女性没有接受常规筛查或项目未达到标准的国家。在成熟的筛查项目中,病例主要来自不参加筛查的女性 [2,3]。
鉴于现有的宫颈癌预防策略,高效且成本效益好,WHO 于 2020 年发起了一项全球倡议,旨在21世纪内消除宫颈癌这个公共卫生问题,即「全球加速消除宫颈癌战略」[4]。与传统的细胞学或阴道镜检查相比,HPV 检测已被证明更敏感、重复性好,允许更安全的延长的筛查间隔 [5,6]。HPV检测对操作员专业知识的依赖程度较低,因此更适合资源有限的情况。此外,可以对女性自己收集的阴道样本进行 HPV 检测,即「自采样」。自采样是一种安全且简单的方法,增加了覆盖筛查女性的机会,否则这些女性很大概率不会参与基于临床医生的筛查,或任何便于她们获得筛查测试的项目 [7]。
调查分析确认,由于易用性、便利性、隐私保护,及身心舒适度等方面的优势,自采样作为一种宫颈癌筛查方法,在高收入和中低收入国家均拥有很高的接受度。此外,对于宫颈癌前病变2期或更高级别病变的病例(CIN2+),「自采样」已被证实具有与「临床医生收集方式」相当的诊断准确性 [8-10]。
尽管有诸多优势,但阴道自采样的实施仍面临挑战,包括培训医护人员向参与的妇女充分解释自取样程序、收集标本的运输、实验室对宫颈和阴道样本处理之间的技术差异,以及最后,熟练的临床医生来管理和跟进阳性病例 [11]。重要的是,还要包括 HPV 阳性女性的临床管理方法和随访系统,以及确认 HPV 自采样阴性结果的长期保护。尽管这一点需要更多证据,目前来看,「临床医生收集方式」HPV 阴性结果女性的五年筛查间隔,似乎也适用于自采样阴性个体 [12]。
因此,WHO 现在推荐基于 HPV 检测的初级筛查,并将「自采样」纳入最近发布的健康自我干预指南中,作为宫颈癌筛查指南的一部分 [7]。同时,国际癌症研究机构对宫颈癌筛查方法的有效性的更新也支持这一说法 [13]。此外,COVID-19 大流行加速了 HPV 自采样的推广,因为它降低了接触病毒的风险并扩大了卫生服务,有助于解决筛查延误的问题。本工作目的是首次在推荐 HPV 筛查的国家中,总结自采样方法的使用情况。
方法
这项工作属于一个更大的项目,该项目描述了世界范围内的宫颈癌筛查计划,并对宫颈癌筛查覆盖率进行标准化评估(Bruni, Serrano et al.)。简而言之,该项目对截至 2020 年 10 月的科学文献和官方文件进行总结,以确定关于 194 个世卫组织成员国和 8 个相关国家和地区的官方建议和宫颈癌筛查覆盖率的所有可用数据。
搜索算法包括在官方网站(例如,卫生部门和国家流行病学机构)中进行初步搜索,然后使用互联网搜索引擎进行全球检索。另外,在PubMed文献库中,使用与每个特定国家的“宫颈癌”、“筛查”和“覆盖”相关的术语组合,进行了系统搜索。参考文献列表也纳入了审查以获取更多信息。专业翻译人员提供了协助。所有检索到的官方信息都经过交叉核对,并补充了对 2019 年世卫组织非传染性疾病国家能力调查的官方答复。
数据搜索最终得到了世卫组织国家的咨询补充(20201127至20210212)。基于联合国分类系统与世界银行收入水平划分标准,将相关国家分为五个地理区域。本次数据作为第一版发布,计划未来保持更新,以监测全球范围内自采样方式的使用情况。
结果
总共有139 个(69%)国家和地区发布了宫颈癌筛查的官方建议。截至 2021 年 2 月,48 个(24%)国家建议进行基于 HPV 的初级筛查。HPV检测被建议单独进行,或与其他筛查检测结合使用。大多数国家正在将初级筛查从细胞学转换为HPV检测。在 2020 年,六个国家报告了将在未来一两年内引入基于 HPV 检测的筛查计划(图1,加拿大、新西兰、比利时、白俄罗斯、日本和特立尼达和多巴哥)。在 140 个中低收入国家中,17% 引入了这种筛查(三个低收入国家、五个中低收入国家和 16 个中高收入国家),而在 62 个高收入国家中这一比例为 39%。
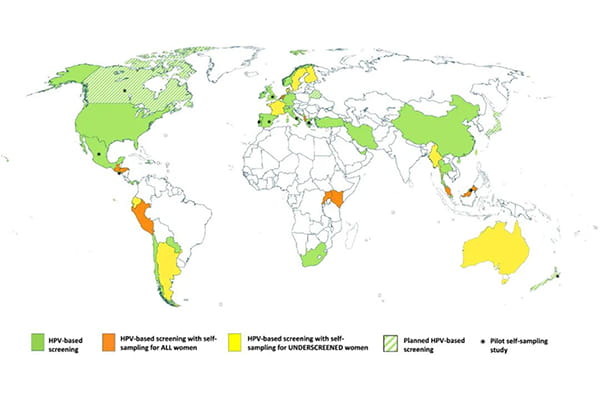
图1 在官方推荐 HPV 筛查的国家中,「自采样」的使用情况
在有 HPV 的初筛计划的48 个国家中,17 个(35%)在官方计划或指南中引入了「自采样」,其中 8 个国家用于筛查不足的女性(阿根廷、澳大利亚、丹麦、厄瓜多尔、芬兰、法国、缅甸和瑞典),9 个国家将其作为所有女性的主要筛查方式(阿尔巴尼亚、肯尼亚、危地马拉、洪都拉斯、马来西亚、荷兰、秘鲁、卢旺达和乌干达)。这些国家中的大多数,在启动 HPV 筛查计划时就引入了「自采样」(图1,表1)。
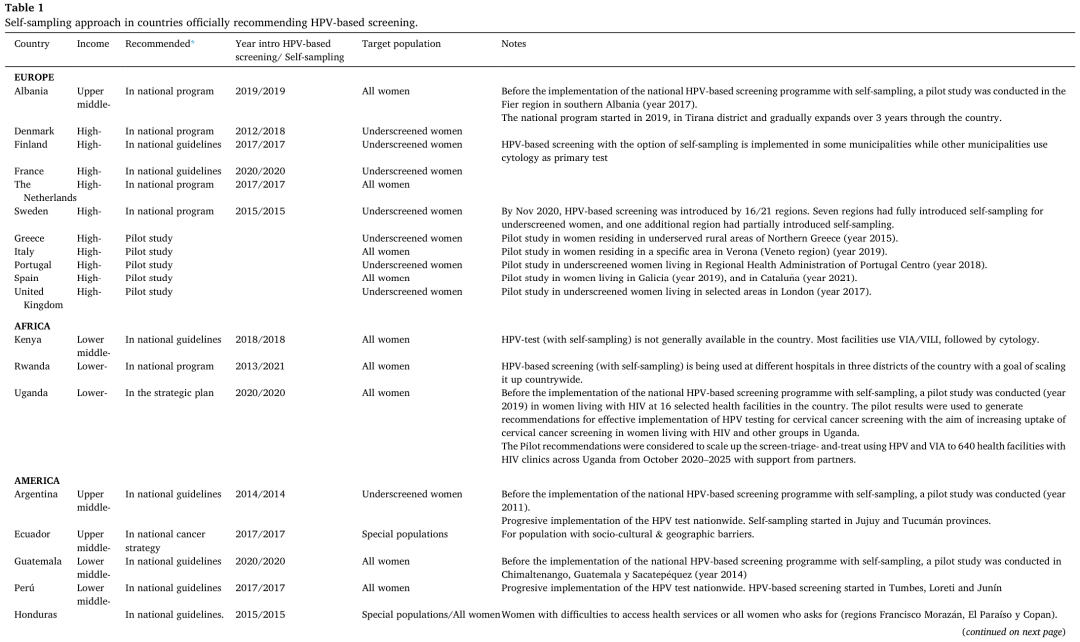
表1 实施HPV筛查国家的「自采样」情况
在推荐 HPV 自采样的 17 个国家中,两个 (12%) 属于低收入国家,五个 (29%) 属于中低收入国家,四个 (24%) 属于中上收入国家,六个 (35%) 属于高收入国家。另外八个国家也在试点「自采样」,以决定是否将其纳入官方筛查指南,要么针对所有女性(文莱、墨西哥、意大利、西班牙),要么针对筛查不足的人群(萨尔瓦多、希腊、墨西哥、葡萄牙和英国)。
大多数推荐 HPV 筛查的国家位于欧洲(17个)和美洲(16个),其中三分之一的国家也在其筛查建议中引入了「自采样」,另有7个国家正在试点「自采样」方法。在计划引入 HPV 筛查的六个国家中,新西兰和加拿大也在试点「自采样」(图1,表1)。
讨论
越来越多的国家在宫颈癌筛查中引入病毒学检测,在这个国际背景下,本工作首次总结了目前在全球范围内使用 HPV「自采样」进行筛查的情况。目前,在发布官方筛查建议的 139 个国家中,有 35% 提倡使用基于 HPV 的初级筛查。在本次调研时,仅有 17 个国家推荐使用 HPV 自采样,其中 35% 的国家推荐基于 HPV 的筛查。8 个国家建议将「自采样」用于覆盖筛选不足的人群,9 个国家将其作为主要收集方法。在另外十个国家,「自采样」处于试点阶段。
长期以来,国际上一直建议,目标女性的最低筛查覆盖率需要达到 70%,才可以观察到早期筛查对疾病死亡率的影响。世卫组织的宫颈癌消除计划正在加强这一目标,即 70% 的 35-45 岁女性至少接受两次高效检测,90% 的确诊病变的患者接受治疗 [4]。目前,筛查和治疗已发现的宫颈病变是短期内减少宫颈癌的主要策略。然而,最新数据显示,大多数国家的计划实施效果并不理想:三分之二的 30-49 岁女性从未接受过筛查。这在高收入和中低收入国家之间有着明显的差异,前者有高达 83%的筛查覆盖率,而后者仅为27%。此外,55 个(39%)中低收入国家仍然缺乏宫颈癌筛查项目,其中大部分来自非洲和亚洲。
在 HPV 初级筛查中使用「自采样」,是一个增加筛查覆盖率的关键机会,尤其是在资源不足的地区(例如,基础设施、专业人员非常有限)。尽管目前只有 11 个中低收入国家在其官方建议中引入了「自采样」,但必须强调的是,消除宫颈癌的意识提高,未来几年内,可能会促进「自采样」在全球的应用。
然而,经济因素和医疗保健配置的变化可能会限制 HPV 筛查的实施。检测成本被认为是 HPV 初级筛查的一个重大障碍,但建模研究已经证明,即使是单一的高精度筛查也能让个体在整个生命周期受益 [14]。重要的是,目前正在开发几种专门为中低收入国家设计的新的、更实惠的检测方法,允许即时 HPV 检测 [15]。基于 HPV 的「自采样」筛查是一种极具成本效益的方法。它克服了许多中低收入国家面临的人力限制,因为只有筛查呈阳性的女性才需要进行妇科检查,从而提高了医疗专业人员的效率 [16]。
自采样设备的另一个优点是它们不需要冷链并且在收集后很稳定,从而最大限度地减少了运输到检测机构所需的基础设施和物流 [17]。然而,确保对筛查阳性结果进行充分的跟进和管理至关重要。如果不是这样,仅筛查覆盖的提高是没有实际效果的 [12,18,19]。此外,感染人类免疫缺陷病毒(HIV)的女性患宫颈癌的风险增加,在该人群中使用自采样的数据有限,可能需要在 HIV 流行率高的环境中进行额外的准确研究 [20]。
我们的分析结果表明,HPV「自采样」主要用于覆盖筛查不足的人群。在许多国家,COVID-19 疫情扰乱了宫颈癌筛查计划,改变了将「自采样」作为所有女性主要筛查方法的观点。最近,有研究全面评估了疫情影响,以及加强全球癌症筛查活动的主要经验。讨论了如何更新宫颈癌筛查,使其实施起来更具弹性,强调基于风险的管理、基于 HPV 筛查的优势,特别是使用 HPV「自采样」[21]。
HPV「自取样」是一种很有前景的策略,可以克服资源匮乏地区宫颈癌筛查的多重障碍,并在筛查计划完善的国家增加筛查不足的女性的覆盖率。HPV「自采样」方法可能是提高宫颈癌筛查的可及性和采用率的唯一途径,尤其是在疾病负担最重的地区,并且现在被认为是实现 WHO 消除宫颈癌这一目标的关键因素 [7,16]。早期实施经验有利于对新项目和现有项目的决策。
[1]. J. Ferlay, M. Ervik, F. Lam, M. Colombet, L. Mery, M. Piñeros, A. Znaor, I. Soerjomataram, F. Bray. Global Cancer Observatory: Cancer Today. International Agency for Research on Cancer, Lyon, France (2020).
[2]. V.B. Benard, J.E. Jackson, A. Greek, V. Senkomago, W.K. Huh, C.C. Thomas, et al. A population study of screening history and diagnostic outcomes of women with invasive cervical cancer. Cancer Med., 10 (12) (2021 May 21), pp. 4127-4137.[3]. R. Ibáñez, M. Alejo, N. Combalia, X. Tarroch, J. Autonell, L. Codina, et al. Underscreened women remain overrepresented in the pool of cervical cancer cases in Spain: A need to rethink the screening interventions. Biomed. Res. Int., 2015 (2015 Jun 9), p. 605375.[4]. Global strategy to accelerate the elimination of cervical cancer as a public health problem. Available from: https://www.who.int/publications-detail-redirect/9789240014107.[5]. G. Ronco, J. Dillner, K.M. Elfström, S. Tunesi, P.J.F. Snijders, M. Arbyn, et al. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet., 383 (9916) (2014 Feb 8), pp. 524-532.[6]. M. Arbyn, G. Ronco, A. Anttila, C.J.L.M. Meijer, M. Poljak, G. Ogilvie, et al. Evidence regarding human papillomavirus testing in secondary prevention of cervical cancer. Vaccine., 30 (Suppl. 5) (2012 Nov 20), pp. F88-F99.[7]. WHO Guideline on self-care interventions for health and well-being. Available from: https://www.who.int/publications-detail-redirect/9789240030909 (2021).[8]. H. Nishimura, P.T. Yeh, H. Oguntade, C.E. Kennedy, M. Narasimhan. HPV self-sampling for cervical cancer screening: a systematic review of values and preferences. BMJ Glob. Health, 6 (5) (2021 May), p. e003743.[9]. M. Arbyn, S.B. Smith, S. Temin, F. Sultana, P. Castle. Detecting cervical precancer and reaching underscreened women by using HPV testing on self samples: updated meta-analyses. BMJ., 363 (2018 Dec 5), p. k4823.[10]. A. Kamath Mulki, M. Withers. Human Papilloma Virus self-sampling performance in low- and middle-income countries. BMC Womens Health, 21 (1) (2021 Jan 6), p. 12.[11]. D. Hawkes, M.H.T. Keung, Y. Huang, T.L. McDermott, J. Romano, M. Saville, et al. Self-Collection for Cervical Screening Programs: From Research to Reality. Cancers., 12 (4) (2020 Apr 24), Article E1053.[12]. L. Zhang, X.-Q. Xu, S.-Y. Hu, F. Chen, X. Zhang, Q.-J. Pan, et al. Durability of clinical performance afforded by self-collected HPV testing: A 15-year cohort study in China. Gynecol. Oncol., 151 (2) (2018 Nov), pp. 221-228.[13]. V. Bouvard, N. Wentzensen, A. Mackie, J. Berkhof, J. Brotherton, P. Giorgi-Rossi, et al. The IARC Perspective on Cervical Cancer Screening. N Engl J Med., 385 (20) (2021 Nov 10), pp. 1908-1918.[14]. K. Canfell, J.J. Kim, M. Brisson, A. Keane, K.T. Simms, M. Caruana, et al. Mortality impact of achieving WHO cervical cancer elimination targets: a comparative modelling analysis in 78 low-income and lower-middle-income countries. Lancet, 395 (10224) (2020), pp. 591-603.[15]. M. Arbyn, E. Weiderpass, L. Bruni, S. de Sanjosé, M. Saraiya, J. Ferlay, et al. Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis. Lancet Glob. Health, 8 (2) (2020 Feb), pp. e191-e203.[16]. de Sanjose, F. Holme. What is needed now for successful scale-up of screening? Papillomavirus Res., 7 (2019 Apr 16), pp. 173-175.[17]. H.-W. Cho, J.-H. Hong, J.K. Lee. Detection of high-risk human papillomavirus infection and treatment of high-grade vaginal intraepithelial neoplasia: A single-institution study. Int. J. Gynaecol. Obstet., 154 (2) (2021 Jan), pp. 227-232.[18]. F. Verdoodt, M. Jentschke, P. Hillemanns, C.S. Racey, P.J.F. Snijders, M. Arbyn. Reaching women who do not participate in the regular cervical cancer screening programme by offering self-sampling kits: A systematic review and meta-analysis of randomised trials. Eur. J. Cancer, 51 (16) (2015 Nov 1), pp. 2375-2385.[19]. M. Paolino, J. Gago, A.L. Pera, O. Cinto, L. Thouyaret, S. Arrossi. Adherence to triage among women with HPV-positive self-collection: a study in a middle-low income population in Argentina. Ecancermedicalscience., 14 (2020), p. 1138.[20]. J.P.H. Wong, M. Vahabi, J. Miholjcic, V. Tan, M. Owino, A.T.W. Li, et al. Knowledge of HPV/cervical cancer and acceptability of HPV self-sampling among women living with HIV: A scoping review. Curr. Oncol., 25 (1) (2018 Feb), pp. e73-e82.[21]. N. Wentzensen, M.A. Clarke, R.B. Perkins. Impact of COVID-19 on cervical cancer screening: Challenges and opportunities to improving resilience and reduce disparities. Prev. Med., 151 (2021 Oct 1), p. 106596.

